Liens rapides
Dans cette vidéo enregistrée à l'hôpital St. Hilaire de Rouen pour le congrès des 4C, les Dr Godin et Landolff effectuent une angioplastie du tronc commun proximal avec un minimum d’iode injecté et en utilisant le système ACIST HDi IVUS.
Kodama®
Désormais indiqué pour les procédures vasculaires coronaires et périphériques.
VUE CORONAIRE VUE PÉRIPHÉRIQUEBénéficiez d’une visibilité accrue avec le système ACIST HDi
Vous offrant la possibilité de voir avec certitude.
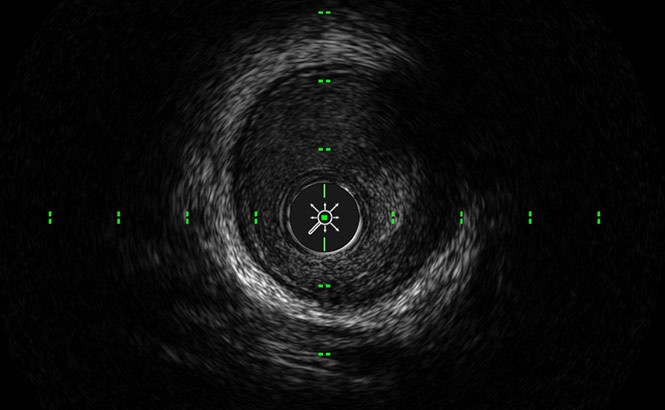
LumenView™
Assombrit la lumière coronaire pour permettre une meilleure détection des bords.
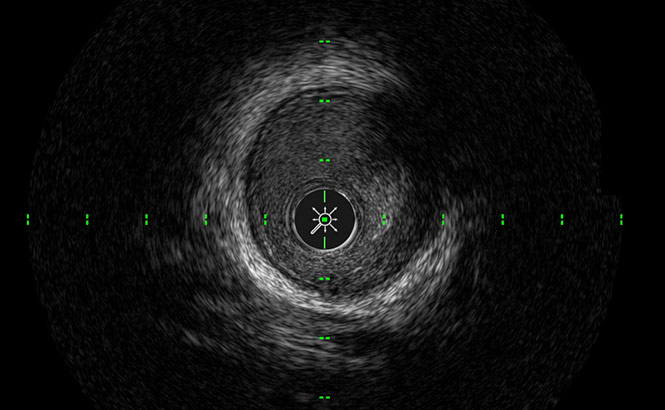
SilkView™
Augmente l’échelle de gris pour permettre une différenciation plus fine des taches sanguines, des tissus et de la plaque.
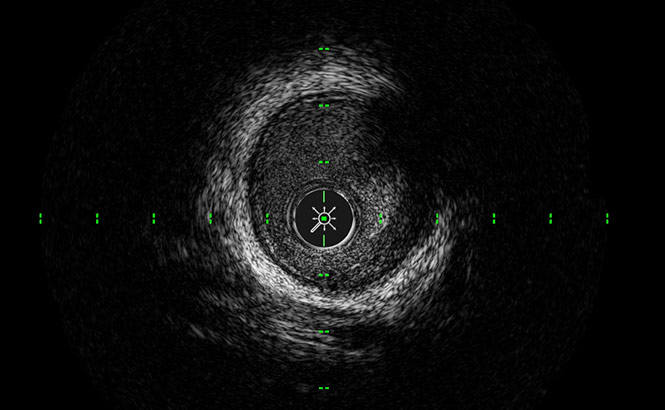
ClassicView™
Optimise l’équilibre entre haute résolution et profondeur de pénétration et permet une visualisation complète de la paroi du vaisseau.
IVUS coronaire
Données cliniques
Meilleure visualisation du produit que l’OCT pour optimiser le dimensionnement du stent4
Permet une imagerie améliorée en fournissant une pénétration suffisante à 60 MHz pour voir la couche de produit, même dans des volumes de plaque plus importants4 pour que les médecins puissent maximiser la section transversale du stent et obtenir de meilleurs résultats pour les patients5

Dans 74 % du temps, l’utilisation de l’IVUS a changé la stratégie de traitement pendant la procédure6
Les stents guidés par échographie intravasculaire (IVUS) présentaient également une faible charge de plaque proximale et distale et une MSA plus élevée par rapport au groupe de stents implantés sous angiographie7

Détection des plaques fibro-lipidiques 8 fois supérieure à 60 MHz qu’à 40 MHz8
L’ICP guidée par IVUS est bénéfique pour prévenir la resténose du bord du stent dans les cas de lésions formant une plaque diffuse par rapport à l’angiographie seule9

L’IVUS est moins chère et plus rentable que
l’angiographie dans 71 % des procédures PCI10
IVUS fournit de meilleurs résultats à un moindre coût, et présente un avantage économique plus important, en particulier dans les sous-groupes à risque plus élevé (diabète, insuffisance rénale, SCA)
Ces données reposent sur un modèle économique à vie, tel que le conçoit l’assurance santé italienne.10
Découvrez la différence. Visualisez en toute confiance.19
IVUS périphérique
Données cliniques

L’utilisation de l’IVUS dans les procédures sur les membres inférieurs a été associée à un risque plus faible de complications après l’intervention et à un risque plus faible d’amputation11

2,8 fois moins de revascularisations des lésions cibles à un an de suivi lors de l’utilisation de l’IVUS dans les procédures d’athérectomie directionnelle par rapport à l’angiographie seule12
Les mesures d’estimation visuelle obtenues à partir des images angiographiques étaient systématiquement plus petites dans tous les segments artériels que celles obtenues à partir de l’évaluation IVUS13
69 % de calcium en plus détecté par l’IVUS par rapport à l’angiographie sur les mêmes lésions14
2 fois plus de thrombus identifiés par l’IVUS par rapport à l’angiographie15
4 fois plus de dissections identifiées par l’IVUS après la pose du stent par rapport à l’angiographie16
3,5 fois plus de dissections identifiées par l’IVUS après l’angioplastie par rapport à l’angiographie17
6 fois plus de dissections identifiées par l’IVUS après l’athérectomie par rapport à l’angiographie17
Découvrez la différence. Visualisez en toute confiance.19
Références
- Données internes – TR-07057 – Tests internes
- Données internes – TR-4050 – Résumé de l’étude des performances du cathéter Kodama
- Données internes – TR-07057 – Tests internes
- IVUS-Guided Versus OCT-Guided Coronary Stent Implantation: A Critical Appraisal https://doi.org/10.1016/j.jcmg.2017.09.008
- Defining a new standard for IVUS optimized drug eluding stent implantation: the PRAVIO study. Catheter Cardiovasc Interv. 1er août 2009 ;74(2):348-356. 6. Maehara A, et al – 16 nov. 2018https://doi.org/10.1161/CIRCINTERVENTIONS.117.006243Circulation:
- Cardiovascular Interventions. 2018;11:e006243
https://www.tctmd.com/news/ultimate-ivus-superior-angiography-guiding-pci-less-tvf-1-year. - https://www.tctmd.com/news/ultimate-ivus-superior-angiography-guiding-pci-less-tvf-1-year. https://doi.org/10.1016/j.jacc.2018.09.01 8. Tanaka S, Sakamoto K, Kitahara H, et al. Assessments of lipid plaque and thrombus with a novel high-definition 60-MHz IVUS imaging system: comparison with conventional 40-MHz IVUS and OCT. J Am Coll Cardiol. 2013;62(18_S1):B201-B202 8a. Total of 50 matched cross-sections were analyzed with lipid core identified in 8 cross-sections in an ex-vivo study.
- Impact of the distance from the stent edge to the residual plaque on edge restenosis following DES implantation. PLOS One. 2015;10(3):E0121079. 10. Alberti, A., Giudice, P., Gelera, A. et al. Understanding the economic impact of intravascular ultrasound (IVUS). Eur J Health Econ 17, 185–193 (2016). https://doi.org/10.1007/s10198-015-0670-4
- Panaich, S. S., Arora, S., Patel, N., Patel, N. J., Savani, C., Patel, A., … Badheka, A. O. (2016). Intravascular Ultrasound in Lower Extremity Peripheral Vascular Interventions: Variation in Utilization and Impact on In-Hospital Outcomes From the Nationwide Inpatient Sample (2006–2011). Journal of Endovascular Therapy, 23(1), 65–75. https://doi.org/10.1177/1526602815620780
- Krishnan, P., Tarricone, A., K-Raman, P., Majeed, F., Kapur, V., Gujja, K., … Sharma, S. (2018). Intravascular ultrasound guided directional atherectomy versus directional atherectomy guided by angiography for the treatment of femoropopliteal in-stent restenosis. Therapeutic advances in cardiovascular disease, 12(1), 17–22. doi:10.1177/1753944717745509
- Pliagas, G., Saab, F., Stavroulakis, K., Bisdas, T., Finton, S., Heaney, C., … Mustapha, J. A. (2020). Intravascular Ultrasound Imaging Versus Digital Subtraction Angiography in Patients With Peripheral Vascular Disease. The Journal of Invasive Cardiology, 32(3), 99–103. Retrieved from https://www.invasivecardiology.com/articles/intravascular- ultrasound-imaging-versus-digital-subtraction-angiography-patients-peripheral-vascular-disease?fbclid=IwAR1qh_GQ85jMvJqGpOeYU_So2gaYF7ol5sknbJmoO-GMmB8JjvMd7gscSi0
- Yin D et al. Intravascular Ultrasound validation of contemporary angiographic scores evaluting the severity of calcification in peripheral arteries. J Endovasc Ther 2017; 24:478-87. 15. Shammas et al. Dethrombosis of the lower extremety arteries using the power-pulse spray technique in patients…. J Endovasc Ther 2008;15:570-79. 16. Miki K, Fujii K, Fukunaga M, et al. Impact of post-procedural intravascular ultrasound findings on long-term results following self-expanding nitinol stenting in superficial femoral artery lesions. Circ J 2013; 77:1543-1550. 17. Shammas NW, Torey JT, Shammas WJ, Jones-Miller S, Shammas GA. Intravascular ultrasound assessment and correlation with angiographic findings demonstrating femoropopliteal arterial dissections post atherectomy: results from the iDissection study. J Invasive Cardiol. 2018;30:240–244.
- Krishnan, P., Tarricone, A., K-Raman, P., Majeed, F., Kapur, V., Gujja, K., … Sharma, S. (2018). Intravascular ultrasound guided directional atherectomy versus directional atherectomy guided by angiography for the treatment of femoropopliteal in-stent restenosis. Therapeutic advances in cardiovascular disease, 12(1), 17–22. doi:10.1177/1753944717745509
- Pliagas, G., Saab, F., Stavroulakis, K., Bisdas, T., Finton, S., Heaney, C., … Mustapha, J. A. (2020). Intravascular Ultrasound Imaging Versus Digital Subtraction Angiography in Patients With Peripheral Vascular Disease. The Journal of Invasive Cardiology, 32(3), 99–103. Retrieved from https://www.invasivecardiology.com/articles/intravascular-t sound-imaging-versus-digital-subtraction-angiogra phy-patients-peripheral-vascular-disease?fbclid=IwAR1qh_GQ85jMvJqGpOeYU_So2gaYF7ol5sknbJmoO-GMmB8JjvMd7gscSi0
- Yin D et al. Intravascular Ultrasound validation of contemporary angiographic scores evaluting the severity of calcification in peripheral arteries. J Endovasc Ther 2017; 24:478-87.
- Shammas et al. Dethrombosis of the lower extremety arteries using the power-pulse spray technique in patients…. J Endovasc Ther 2008;15:570-79.
- Miki K, Fujii K, Fukunaga M, et al. Impact of post-procedural intravascular ultrasound findings on long-term results following self-expanding nitinol stenting in superficial femoral artery lesions. Circ J 2013; 77:1543-1550.
- Shammas NW, Torey JT, Shammas WJ, Jones-Miller S, Shammas GA. Intravascular ultrasound assessment and correlation with angiographic findings demonstrating femoropopliteal arterial dissections post atherectomy: results from the iDissection study. J Invasive Cardiol. 2018;30:240–244.’ 8. Data on file – TR-07057 – Internal testing. 9. Data on file – TR-4050 – Study Summary for Kodama Catheter performance.
- Données internes – TRCO-17355
Sur prescription médicale uniquement
Avant utilisation, reportez-vous au Mode d’emploi, qui se trouve à l’intérieur du carton du produit (si disponible) ou à l’adresse <enterwebsite.com> pour des informations plus détaillées sur l’utilisation sûre du dispositif.
Indications d’utilisation :
Le système ACIST HDi® est destiné à être utilisé pour l’examen échographique de la pathologie intravasculaire coronaire et périphérique. L’imagerie échographique intravasculaire est indiquée chez les patients souhaitant bénéficier d’une angioplastie transluminale percutanée. Le cathéter d’échographie intravasculaire ACIST Kodama est conçu pour être utilisé conjointement avec le système ACIST HDi.
Contre-indications :
Contre-indiqué pour les patients atteints de : bactériémie ou septicémie ; spasme artériel ; anomalies majeures du système de coagulation ; valvules cardiaques mécaniques qui seraient traversées par le cathéter ; instabilité ou choc hémodynamique sévère ; occlusion totale du vaisseau (avant les étapes initiales de la revascularisation). Utilisation contre-indiquée dans les artères cérébro-vasculaires. Dans les procédures coronariennes, le produit est également contre-indiqué pour les patients qui ne sont pas admissibles pour une chirurgie de revascularisation ni pour une angioplastie par ballonnet (PTCA).
Informations importantes sur la sécurité :
Les études d’échographie intravasculaire à l’aide de ce produit ne doivent être effectuées que par des médecins et autres professionnels de santé parfaitement formés aux techniques et procédures requises. Le cathéter Kodama comporte un système d’introduction de fil-guide à monorail court. Ce système entraîne un risque d’enchevêtrement et/ou de prolapsus du fil-guide pendant le déploiement ou le retrait du cathéter. Avant utilisation, et à tout moment au cours de l’utilisation du dispositif, inspectez soigneusement le cathéter Kodama à la recherche d’une torsion ou autre dommage. N’utilisez pas un cathéter tordu ou endommagé, susceptible de provoquer une lésion du vaisseau et/ou l’impossibilité d’avancer ou de retirer le cathéter.
En cas de résistance, vous ne devez jamais avancer ou retirer le cathéter Kodama tant que la radioscopie n’a pas permis d’en déterminer la cause. Le déplacement du cathéter ou du fil-guide malgré une résistance peut entraîner une élongation ou une séparation du cathéter ou de la pointe du fil-guide, une détérioration du cathéter ou encore une perforation du vaisseau.
Lors de la progression du cathéter Kodama à travers un vaisseau stenté, les types de cathéter à monorail court sont susceptibles de provoquer un enchevêtrement du fil-guide avec le cathéter, une séparation de leur extrémité et/ou de déloger le stent.
Les effets indésirables qui peuvent se produire à la suite d’une procédure d’imagerie intravasculaire comprennent (entre autres) : occlusion et/ou fermeture brutale du vaisseau, embolie gazeuse, dissection, blessure ou perforation artérielle ; rupture, blessure ou perforation du vaisseau ; infarctus du myocarde aigu ; arythmies cardiaques notamment, mais sans s’y limiter, tachycardie ventriculaire, fibrillation ventriculaire et bloc cardiaque complet ; tamponnade cardiaque, enchevêtrement de cathéter/fil-guide ; ischémie induite par le cathéter ; décès ; traumatisme du vaisseau nécessitant un traitement/une intervention chirurgicale, y compris angioplastie / pose d’un stent ; infection, détérioration des mailles du stent ; attaque (notamment accident vasculaire cérébral et accident ischémique transitoire) ; formation d’un thrombus ou thrombo-embolie ; vasospasme.